

بنهاية العام الماضي، آخر أعوام العقد الثاني من القرن الحادي والعشرين، اخترنا تقنية كريسبر “تقنية التحرر الجيني” على رأس قائمة أهم ما قدمه العلم للبشرية في عشر سنوات.
الآن، تحصل الباحثتان الأمريكية جينيفر دودنا والفرنسية إيمانويل شاربينتيه على جائزة نوبل للكيمياء 2020 بسبب عملهما لتطوير أحد أكبر وأهم القصص العلمية في السنوات القليلة الماضية.
خلال العقد الماضي، وبفضل دودنا وإيمانيويل، نجحنا في التعديل على الحمض النووي DNA بدقة عالية بفضل التسلسل الجيني Crisper أو (Clustered Regularly Interspaced Short Palindromic Repeats – التكرارات العنقودية المتناظرة القصيرة منتظمة التباعد)، وهو تسلسل جيني يحمل فواصل متقطعة داخل الحمض النووي. بداخل تلك الفواصل بيانات للفيروسات التي سبق أن هاجمت الجسم. ومنها يمكن التعديل والإضافة والحذف على تلك الفواصل.
تقنية كريسبر لا تقتصر على البشر حصرًا، بل تمتد إلى الأغذية والحيوانات، وصنع أدوية جديدة، وغيرها. مكنتنا من حذف السمات غير المرغوب فيها، وربما إضافة سمات مرغوبة، بدقة أكبر من أي وقت مضى.
حتى الآن استخدم العلماء تقنية كريسبر لتقليل شدة الصمم الوراثي لدى الفئران، مما يشير إلى أنه يمكن استخدامه يومًا ما لعلاج نفس النوع من فقدان السمع لدى البشر.
صنعنا عيش الغراب (المشروم) الذي لا يتحول إلى اللون البني بسهولة، وعدلنا خلايا نخاع العظام لثلاثة مرضى لعلاج فقر الدم المنجلي الوراثي.
مستقبلًا، قد تساعدنا تقنية كريسبر في تطوير محاصيل مقاومة للجفاف وإنتاج مضادات حيوية جديدة قوية، وغيرها.
هنا، نستعرض بشكل أكبر استخدامات التقنية. لكن دعنا نذهب بعيدًا، إلى البدايات.
الثقوب السوداء بطل نوبل الفيزياء 2020.. ما توقعه أينشتاين لكنه رفض تصديق وجوده | فادي داوود
لنعود إلى 1987 لفهم تقنية كريسبر. حينها، اكتشف العلماء اليابانيون الذين درسوا نوعًا من البكتيريا “العصيات القولونية” لأول مرة بعض التسلسلات المتكررة غير العادية في الحمض النووي للكائن الحي.
لم يعلم حينها العلماء أهمية تلك التسلسلات، وكتبوا في الورقة البحثية المنشورة في دورية Journal Of Bacteriology تعليقًا على اكتشافهم أن: “الأهمية البيولوجية لهذه التسلسلات غير معروفة”.
بعد فترة قليلة، اكتشف باحثون هذا التسلسل في نوع آخر من البكتيريا. حينها أخذ هذا الاسم “التكرارات العنقودية المتناظرة القصيرة منتظمة التباعد” أو تقنية كريسبر.
لكن الاكتشاف ظل مجرد معلومة غير معروف أهميتها حتى 2007، عندما كان العلماء يفحصون البكتيريا السبحية Streptococcus المستخدمة في صنع الزبادي، فوجدوا أن تلك التسلسلات داخل البكتيريا تؤدي وظيفة حيوية، وأنها جزء من الجهاز المناعي للبكتيريا.
نوبل 2019| السرطان “وغيره” تحت السيطرة.. 4 آلاف “كوكب تاني”.. بطارية موبايلك.. وسيارتك المستقبلية
ماذا يحدث عندما تصاب بمرض ما؟ كيف يسجل جهازك المناعي تلك الإصابة؟ وكيف يحتفظ جسمك بشفرتك الوراثية بكل ما تحملها من صفات “لون، عرق، طول، وغيرها” وأيضًا تاريخك المرضي؟
لنبسط الأمر: أحد أدوار البكتيريا – وهي كائنات حية دقيقة داخل جسم أي كائن – هو تمرير المادة الوراثية “الحمض النووي” بين الخلايا.
تلك البكتيريا تتعرض لهجوم مستمر من الفيروسات. لذا تنتج إنزيمات لمحاربة الهجمات الفيروسية. كلما تمكنت إنزيمات البكتيريا من قتل الفيروس الدخيل على الجسم، أتت إنزيمات صغيرة أخرى، لتلتقط بقايا الشفرة الجينية للفيروس، وتقطعها إلى أجزاء صغيرة جدًا. تخزن الإنزيمات بعد ذلك تلك الشظايا في مساحات (مقصات) كريسبر في جينوم البكتيريا نفسها.
ويحتفظ الجسم بنسخة من الفيروس ويمررها لكل الخلايا، لتظل داخل شفرته الوراثية للأبد.
يأتي الآن الجزء الذكي والعظيم. تستخدم البكتيريا تلك المقصات أو الشفرة الفيروسية التى حصلت عليها للتعرف على الفيروس حالة حدوث عدوى فيروسية جديدة. حينها تنتج البكتيريا إنزيمات جينيه تعرف باسم Cas9 تحمل تحديدًا الأجزاء المخزنة من الشفرة الوراثية الفيروسية.
عندما تصادف إنزيمات Cas9 فيروسًا، فإنها تختبر ما إذا كان الحمض النووي الريبي للفيروس يطابق ما هو موجود في التسلسل الجيني. إذا حدث التطابق، يبدأ إنزيم Cas9 دوره كمقص في تقطيع الحمض النووي للفيروس لتحييد التهديد ومنعه.
يحدث هذا كل مرة وبشكل مستمر داخل جسمك. تلك المقصات دقيقة للغاية، وتحمل تسلسلات جينية واضحة، خصوصًا لعلماء الأحياء الدقيقة.
أصل الأنواع | أكبر تحد لنظرية داروين | عصفور أجنبي تزوج حديثا بعصفورة محلية | الحكاية في دقائق

في 2011، كانت جينيفر دودنا وإيمانويل شاربينتير الحاصلتين على نوبل في الكيمياء 2020 تتشاركان نفس الاهتمامات والتساؤلات، حين التقيتا صدفة خلال مؤتمر علمي في بورتريكو.
كانت تساؤلاتهما متشابهة ومباشرة:
خدعتا بروتين Cas9 عبر إطعامه الحمض النووي الريبي الاصطناعي المرغوب إضافته للبكتيريا.
حينها، سيبحث الإنزيم Cas9 عن أي شيء بنفس الشفرة، وليس الفيروسات فقط، ويبدأ في التقطيع. ويقدم لنا على طبق من ذهب فواصل دقيقة للغاية لجيناتنا، جاهزة للاستبدال أو التعديل عليها! Bingo!
توثيقًا لاكتشافهما، وفي بحث تاريخي عام 2012، أظهرت دودنا وشاربنتيير أن بإمكانهما استخدام نظام CRISPR / Cas9 هذا لتقطيع أي جينوم في أي مكان يريدون.
نوبل الطب 2020 | ملحمة إنقاذ البشرية من فيروس سي بانتظار الفائز الرابع | فادي داوود
منذ ذلك الحين، وجد الباحثون أن تقنية كريسبر CRISPR / Cas9 متعددة الاستخدامات بشكل مذهل. لا يقتصر استخدامها على “تحييد أو إسكات” الجينات عن طريق قصها، بل تسخير التقنية لاستبدال الجينات غير المرغوب فيها.
يمكن للعلماء مثلًا أن يطلبوا من إنزيم CAS9 اقتطاع جين معين يسبب مرضًا ما أو صفة ما غير مرغوبة، وإدخال جين جديد يحل محله.
من 2011 إلى 2015، نشرت دودنا 83 بحثًا، 40 منها تخص تقنية كريسبر CRISPR-Cas9، وتلقت في المتوسط 117 اقتباسًا لكل بحث. خلال نفس الوقت نشرت إيمانويل 29 بحثًا تلقت ما معدله 162.9 اقتباسًا لكل بحث.
في 2011، كان هناك أقل من 100 بحث منشور عن تقنية كريسبر. في 2018 ، كان هناك أكثر من 17,000 ورقة بحثية عن تقنية كريسبر.
التعديل الجيني بحد ذاته ليس جديدًا. هناك تقنيات مختلفة للتعديل الجيني مثل TALEN وZFN. لكن ما يجعل تقنية كريسبر CRISPR ثورية للغاية أنها دقيقة جدًا وسريعة نوعًا ما.
مريض لندن يتعافى من الإيدز بالصدفة.. هل يفتح باب القضاء على مرض بلا علاج؟ | س/ج في دقائق
تقنية كريسبر CRISPR تسهل على الباحثين معرفة ما تفعله الجينات المختلفة في الكائنات الحية. مثلًا، من خلال التخلص من الجينات الفردية ومعرفة السمات المتأثرة بكل جين عند فصله.
وما سهل الأمر أكثر أننا نملك خريطة كاملة ومفصلة للجينوم البشري. وعن طريق تقنية كريسبر يمكننا معرفة وظيفة كل جين داخل شفرتنا الوراثية.
يمكن أن تأتي المتعة الحقيقية – وربما المخاطر الحقيقية – من استخدام تقنية كريسبر لتعديل مختلف النباتات والحيوانات. ورقة بحثية صدرت في 2016 عبر Nature Biotechnology بقلم رودولف بارانجو ودودنا تحمل مجموعة من التطبيقات المحتملة في المستقبل لن نتطرق لها الآن، ولكن دعنا نستعرض بالفعل أمثلة لما تم تحقيقه على أرض الواقع بفضل تقنية كريسبر.
في العادة، أي كائن حي لديه فرصة 50-50 لنقل جين معين لأبنائه ومنها لجيله. ولكن باستخدام تقنية كريسبر يمكن للعلماء تغيير هذه الاحتمالات، بحيث يكون هناك فرصة بنسبة 100٪ تقريبًا لانتقال جين معين. باستخدام الإجبار الجيني، يمكن للعلماء ضمان انتشار الجين المتغير في جميع أنحاء مجموعة سكانية بأكملها في وقت قصير:
الإجبار الجيني Gene Drive وهي تقنية استخدمت لوقف انتشار الملاريا الذي ينقله البعوض “ذبابة الفاكهة” بتعديل البعوض وراثيًا ليحمل صفة مقاومة حمل المرض، لتنتشر هذه الصفة بشكل كلي في الأجيال اللاحقة عند تزاوجه مع بعوض غير مقاوِم لحمل المرض، لينشأ جيل جديد مقاوم تمامًا.
نجحت تقنية كريسبر أيضًا في علاج ثلاث مرضى مصابين بأمراض دم وراثية” beta thalassaemia and ، sickle cell disease الثلاسيما وفقر دم المنجلى، تلك الأمراض تأثر بشكل مباشر على إنتاج وتكوين هيموجلوبين الدم مسببة نقصا حادا، أصحاب تلك الأمراض مضطرون طوال فترة حياتهم لنقل الدم بشكل دوري، هنا تدخلت تقنية كريسبر وقام علماء بتعديل جيني ساهم في علاجهم عن طريق إزالة الخلايا الجذعية من نخاع عظم المرضى وتعطيل الجين الذي يوقف إنتاج الهيموجلوبين.
بفضل تقنية كريسبر استعاد رجل أعمى البصر عن طريق حقن عين رجل فاقد للبصر ثلاث قطرات من سائل يحتوي على قطع حمض نووي معدل بتقنية كريسبر. المريض فقد البصر منذ طفولته بعد الولادة بسبب حالة نادرة اسمها Leber congenital amaurosis وهي عبارة عن طفرة جينية تمنع الجسم من إنتاج البروتين اللازم لتحويل الضوء إلى إشارات إلى الدماغ.
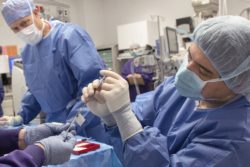
التقنية لها دور واعد في علاج السرطان. داخل جامعة بنسلفانيا، عولج 3 مصابين بالسرطان بالتعديل على الخلايا التائية لهم لمهاجمة البروتين الموجود فى الخلايا السرطانية. تم نشر تجارب تلك العملية في ورقة بحثية.
تطلع علماء المحاصيل بالفعل لاستخدام تقنية كريسبر لتعديل جينات المحاصيل المختلفة لجعلها ألذ أو أكثر تغذية أو تنجو بشكل أفضل من الحرارة والضغط. تمكن العلماء مثلًا من استخدام تقنية كريسبر لاقتطاع المواد المسببة للحساسية في الفول السوداني.
واحدة من أكثر الحقائق المخيفة هي أننا على وشك الإفلاس من المضادات الحيوية، حيث تطور البكتيريا مقاومة لها. في الوقت الحالي، من الصعب والمكلف تطوير مضادات حيوية جديدة للعدوى المميتة. لكن يمكن، نظريًا، تطوير أنظمة CRISPR / Cas9 للقضاء على بكتيريا معينة بدقة أكبر من أي وقت مضى، يعمل باحثون الآن باستخدام تقنية كريسبر لتطوير مضادات فعالة لفيروسات مثل فيروس نقص المناعة البشرية والهربس.
الفيروسات والتطور | بسبب الفيروسات صرنا بشرا كما نعرف أنفسنا | رواية صحفية | خالد البري

توصل العلماء مؤخرًا إلى أن أسلوب تحرير الجينات يمكن أن يمحو دون قصد أجزاء كبيرة من الحمض النووي، ويعيد ترتيبها بطرق قد تعرض صحة الإنسان للخطر. يأتي ذلك بعد الدراسات الحديثة التي أظهرت أن الخلايا المعدلة بتقنية كريسبر CRISPR يمكن أن تسبب السرطان عن غير قصد. هذا هو السبب في أن العديد من العلماء يجادلون بأن التجارب على البشر سابقة لأوانها: المخاطر والشكوك حول تعديل كريسبر عالية للغاية.
هذا ما حدث في الصين منذ عامين، عندما أعلن العالم هي جيانكوي عن ولادة أنثيين توأم مقاومتين لفيروس نقص المناعة البشرية. أذهل الإعلان العلماء في جميع أنحاء العالم. واعتبر المجتمع العلمي أن التجربة كانت “مزعجة للغاية وتتجاوز المعايير الأخلاقية.” تم إيقاف الطبيب الصيني وصدر حكم ضده بالحبس 3 سنوات.
الجانب المثالي من تقنية كريسبر يمكننا من تحييد وإزالة الأمراض الوراثية من الظهور في الأجيال القادمة، وأيضًا عن طريقها يمكننا اختيار صفات الجنين، بل والتعديل عليها لإظهار صفات معينة (طول، لون بشرة، لون عين وغيرها) الأمر الذى يواجه اعتراضات أخلاقية ودينية كبيرة.
نظرًا لجميع القضايا الشائكة المرتبطة بتعديل الجينات، فإن العديد من العلماء يدعون إلى اتباع نهج بطيء هنا. إنهم يحاولون أيضًا إبقاء المناقشة حول هذه التكنولوجيا مفتوحة وشفافة. تقنية كريسبر لا يوجد بها إلغاء اشتراك، إذا قام أحدهم بالتعديل الجيني في خاصية معينة داخل البشر لن يستطيع الجيل التالي إلغاء الاشتراك.
على الصعيد الآخر هناك صوت علمي متصاعد يطالب أن تكون التجارب السريرية على البشر مستمرة، خصوصًا للظروف والأمراض الخطيرة ولكن تحت إشراف صارم.
 موضوعات متعلقة
موضوعات متعلقة