

نظرًا لأن النموذج الذري لـ JJ Thomson كان معيبًا وكان له عيوب كبيرة، فقد اقترح إرنست رذرفورد نموذجًا أحدث كان بمثابة قاعدة للنماذج الذرية التالية. بحثًا عن إجابات تتعلق بترتيب الإلكترونات داخل الذرة، أجرى رذرفورد تجربة اصطدمت فيها جسيمات ألفا سريعة الحركة برقائق ذهبية رفيعة.
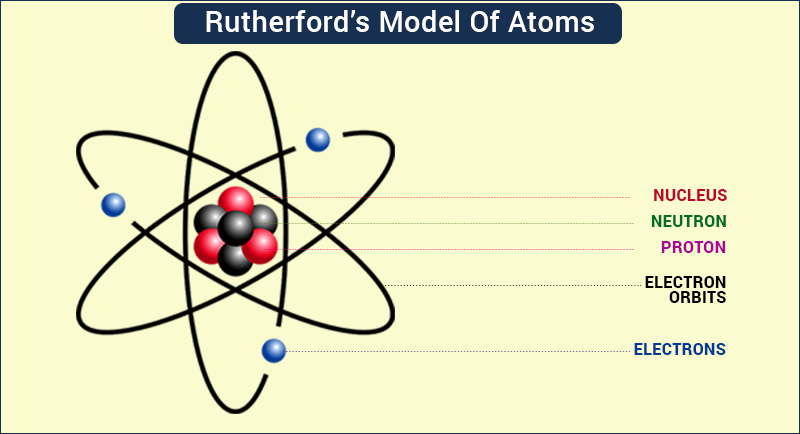
وفقًا لنموذج رذرفورد الذري، تركزت الجسيمات موجبة الشحنة ومعظم كتلة الذرة في حجم ضئيل. أطلق على هذه المنطقة من الذرات نواة. اقترح نموذج رذرفورد النووي أيضًا أن الإلكترونات سالبة الشحنة تحيط بنواة الذرة. اقترح رذرفورد أيضًا أن الإلكترونات تتحرك بسرعة الضوء حول النواة. أطلق على هذه المسارات الدائرية اسم مدارات.
من خلال تحسين نموذج طومسون للذرة، صور رذرفورد في عام 1911 أن الذرة لديها نواة كثيفة بمساعدة تجربة رقائق الذهب ، وبالتالي تحسين فهم النموذج الذري. قبل خمس سنوات، لاحظ أن جسيمات ألفا التي تنتقل عبر ثقب على لوحة بيانية ستشكل صورة حادة الحواف. في المقابل، تنتقل جسيمات ألفا عبر صفيحة من الميكا بسمك 20 ميكرومترًا فقط من شأنها أن تخلق تأثيرًا بحواف ضبابية. بالنسبة لبعض الجسيمات، كان التمويه يشبه انحرافًا بمقدار درجتين. تذكر هذه النتائج وكان لدى رذرفورد زميله في مرحلة ما بعد الدكتوراه هانز جيجر وطالب جامعي إرنست مارسدن، صقلوا التجربة عن طريق إشعاع جسيمات ألفا من خلال رقائق الذهب والتعرف عليها على أنها أشعة من الضوء أو وميض على الشاشة.
كان سمك رقائق الذهب 0.00004 سم فقط. مرت معظم جسيمات ألفا مباشرة من خلال الرقاقة، لكن بعضها تم تحويله بواسطة الرقاقة واصطدمت بالبقعة على شاشة موضوعة على جانب واحد. ومع ذلك، لم يتم قبول النموذج الذري بسهولة من قبل جميع الفيزيائيين، لأنه لم يتوافق مع الفهم الكيميائي للذرة آنذاك.
اقترح النموذج أن الشحنة على النواة كانت السمة الأساسية للذرة، والتي تحدد هيكلها. من ناحية أخرى، تم تنظيم جدول مندلييف الدوري للعناصر وفقًا للكتلة الذرية، مما يعني أن الكتلة كانت مسؤولة عن بنية الذرات والسلوك الكيميائي.
يعتمد الفهم الحالي للذرة على النموذج النووي للذرة الذي اقترحه وفسره رذرفورد، والذي يقول أن الذرة لها كتلة مركزية كبيرة وكثيفة تسمى النواة، وهي محاطة بالإلكترونات سالبة الشحنة. البروتونات التي تشكل النواة موجبة الشحنة ، ويمثلها Z، العدد الذري للعنصر.
لكي تكون الذرة محايدة كهربائياً، يجب أن تغطي نفس عدد الإلكترونات خارج النواة التي توجد بها بروتونات في النواة. ومن ثم، فإن عدد الإلكترونات في ذرة محايدة من العدد الذري Z هو أيضًا Z. مثلاً تحتوي ذرة الهيدروجين على بروتون واحد وإلكترون واحد، بينما تتكون ذرة الكربون من ستة إلكترونات. نحن نعلم أن بنية الذرة تتكون من الإلكترونات والبروتونات والنيوترونات.
وتم تقديم هذا بدقة بعد أن طور العديد من العلماء نماذج مختلفة. طور إرنست رذرفورد نموذج رذرفورد الذري ، المعروف أيضًا باسم نموذج رذرفورد للذرة. ومع ذلك ، لم يعد يعتبر تمثيلًا دقيقًا للذرة. من فضلك أخبرنا المزيد عن هذا النموذج.
اقترح رذرفورد أن الذرة تتكون في الغالب من الفضاء، حيث تدور الإلكترونات في مسارات محددة مسبقًا حول نواة ثابتة موجبة الشحنة.
اقترح الفيلسوف اليوناني ديموقريطوس مفهوم الذرة لأول مرة في عام 400 قبل الميلاد. ومع ذلك، لم يقترح جون دالتون فكرة الذرة مرة أخرى حتى عام 1803. كان يعتقد أن الذرات غير قابلة للتجزئة في ذلك الوقت.
استمر مفهوم الذرة كجسيمات غير قابلة للتجزئة حتى عام 1897، عندما اكتشف الفيزيائي البريطاني جيه جيه طومسون جسيمات سالبة الشحنة تعرف بالإلكترونات.بناءً على ذلك ، اقترح نموذجًا يتم فيه دمج الإلكترونات بشكل موحد في مصفوفة موجبة الشحنة. تم إعطاء نموذج حلوى البرقوق بهذا الاسم.
من ناحية أخرى، كان لنموذج بودنغ البرقوق JJ Thomson بعض القيود. لم يكن قادرًا على شرح بعض النتائج التجريبية المتعلقة بالتركيب الذري للعنصر. اقترح عالم الفيزياء البريطاني إرنست رذرفورد نموذجًا للبنية الذرية يُعرف باسم نموذج رذرفورد للذرات. أجرى تجربة قصف فيها جزيئات في صفيحة ذهبية رفيعة. لقد حقق في مسار الجسيمات بعد التفاعل مع الصفيحة الرقيقة من الذهب في هذه التجربة.
في تجربة رذرفورد، قام بقذف رقائق ذهبية رفيعة بجسيمات عالية الطاقة. تم استخدام مصدر مشع لتوجيه تيارات الجسيمات. أجرى تجارب للتحقيق في الخلل الناتج في مسار الجسيمات بعد التفاعل مع صفيحة رقيقة من الذهب.
للتحقق من الانحراف، أحاط بورقة الذهب بغلاف من كبريتيد الزنك. تناقض نموذج بودنغ JJ Thomson مع ملاحظات رذرفورد.
خلص رذرفورد إلى أن مساحة كبيرة في الذرة فارغة بناءً على ملاحظاته أثناء التجربة. مرت نسبة كبيرة من الجسيمات عبر الصفيحة الذهبية دون انحراف.
نتيجة لذلك، يجب أن تكون غالبية الذرة فارغة. لا تتوزع الشحنة الموجبة في الذرة بشكل موحد وتتركز في حجم صغير جدًا عند قصفها، انحرفت الصفيحة الذهبية عن بعض الجسيمات. كانوا ينحرفون في الزوايا الدقيقة والصغيرة. نتيجة لذلك، توصل إلى الاستنتاج أعلاه.
عدد قليل جدًا من الجسيمات انحرفت بزوايا كبيرة أو تم إرجاعها. علاوة على ذلك، فقط عدد قليل من الجسيمات قد انحرفت عند 180 درجة. ونتيجة لذلك خلص إلى أن الجسيمات الموجبة الشحنة تغطي نسبة صغيرة من الحجم الكلي للذرة.
يفترض نموذج رذرفورد الذري على أساس الملاحظات والاستنتاجات تشكل الجسيمات المشحونة إيجابيا الذرة. تتركز غالبية كتلة الذرة في منطقة صغيرة جدًا. سميت نواة الذرة على اسم هذه المنطقة من الذرة. في وقت لاحق تم اكتشاف أن النواة الصغيرة جدًا والكثيفة للذرة تتكون من النيوترونات والبروتونات. ونواة الذرة محاطة بجسيمات سالبة الشحنة تعرف بالإلكترونات. وتدور الإلكترونات بسرعة عالية جدًا حول النواة في مسار دائري ثابت.
تمت تسمية المدارات على اسم هذه المسارات الدائرية الثابتة. نظرًا لأن الإلكترونات مشحونة سالبًا والنواة المركزة بكثافة مشحونة إيجابًا، فإن الذرة ليس لها شحنة صافية أو تكون متعادلة كهربائيًا. النواة والإلكترونات مرتبطة ببعضها البعض بواسطة قوة جذب إلكتروستاتيكية قوية. حجم نواة الذرة صغير جدًا مقارنة بالحجم الكلي للذرة.
لا يمكن تفسير أشياء معينة من خلال تجربة رذرفورد. وهم على النحو التالي
كان نموذج رذرفورد غير قادر على تفسير الاستقرار الذري. وفقًا لافتراض رذرفورد تدور الإلكترونات بسرعة عالية جدًا في مدار ثابت حول نواة الذرة. من ناحية أخرى، أوضح ماكسويل أن الجسيمات المشحونة المتسارعة تصدر إشعاعات كهرومغناطيسية. نتيجة لذلك ، تصدر الإلكترونات التي تدور حول النواة إشعاعًا كهرومغناطيسيًا.
سيحتوي الإشعاع الكهرومغناطيسي على طاقة من الحركة الإلكترونية، مما يتسبب في تقلص المدارات تدريجيًا. أخيرًا ستتقلص مدارات نواة الذرة وتنهار. إذا تم اتباع تفسير ماكسويل، فسوف ينهار نموذج رذرفورد في غضون 10-8 ثوانٍ وفقًا للحسابات.
نتيجة لذلك لم يتوافق نموذج رذرفورد الذري مع نظرية ماكسويل ولم يكن قادرًا على تفسير استقرار الذرة. كانت نظرية رذرفورد تفتقر إلى التفاصيل لأنها لم تتناول ترتيب الإلكترونات في المدار. كان هذا أحد العيوب الرئيسية في نموذج رذرفورد الذري.